ما هو علم التخلق؟
علم التخلق هو دراسة العوامل التي تحدد نشاط أ الجين في الإنسان الجينوم . يتضمن تغييرات في وظيفة الجينات التي لا تستند إلى التغييرات في الحمض النووي متواليات لكنها انتقلت إلى الخلايا الوليدة.
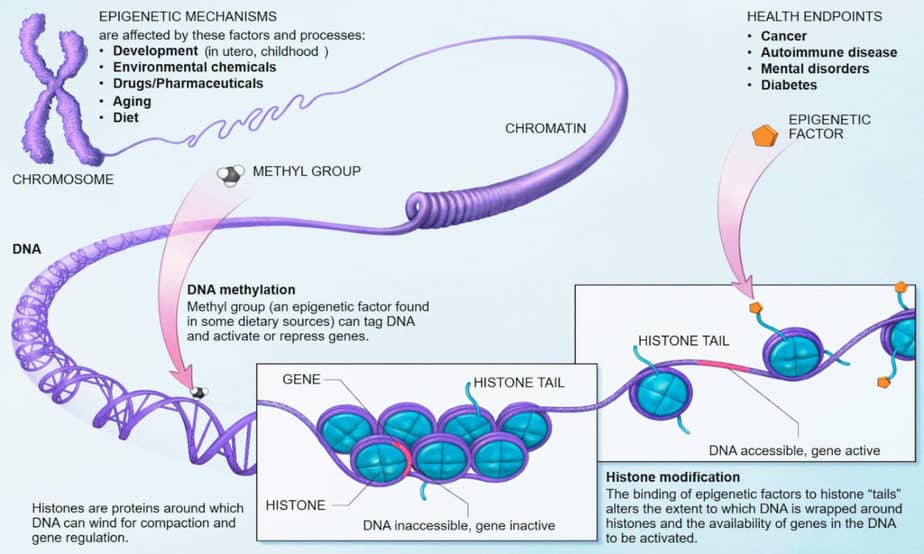
أساس علم التخلق هو التغيرات الكيميائية في الكروماتين. قد يؤثر على البروتينات التي ترتبط بالحمض النووي ، أو الحمض النووي نفسه. يمكن أن تؤثر هذه التغييرات على نشاط الأقسام أو الكروموسومات بأكملها. يشار إلى هذا أيضًا باسم التغيير الجيني أو البصمة اللاجينية.
نظرًا لعدم تغيير تسلسل الحمض النووي ، لا يمكن الكشف عن التعديلات اللاجينية من تسلسل الحمض النووي. تشمل أنواع العمليات الوراثية اللاجينية تعطيل الكروموسومات X أو طبع الجين أو تخزين ذاكرة النسخ للخلايا.
حرره كريستينا سوردز ، دكتوراه.
أساسيات علم التخلق
بعد الإخصاب ، تنقسم خلية البويضة. حتى مرحلة 8 خلايا ، تكون جميع الخلايا الوليدة متساوية. يطلق عليهم اسم كامل القدرة لأن كل منهم لا يزال قادرًا على إنتاج كائن حي كامل بمفرده.
بعد هذه المرحلة ، توجد خلايا ببرنامج داخلي مختلف. هذه الخلايا لديها إمكانات نمو محدودة لأنها تصبح أكثر تخصصًا.
عندما يتشكل الجسم بالكامل ، تتم برمجة معظم خلايا الجسم بحزم لوظيفتها على أساس آليات التخلق المتوالي. تم إصلاح الوظيفة بسبب التعديلات الكيميائية الحيوية للقواعد في الحمض النووي أو الهستونات التي تغلف الحمض النووي ، أو كليهما. يظل تسلسل المادة الجينية دون تغيير باستثناء بعض الطفرات العشوائية.
تؤدي هذه التعديلات اللاجينية إلى “إسكات” مناطق معينة من الجينوم ، أي لا يمكن نسخها بسهولة RNA لتخليق البروتين. تبدو هذه التعديلات مختلفة تمامًا في الخلايا الجسدية عنها في الخلايا الجذعية أو في الخلايا الجرثومية. أهم التعديلات هي مثيلة قواعد السيتوزين وميثلة السلسلة الجانبية وأستلة الهستونات.
إلى جانب المثيلة ، فإن التيلوميرات لها تأثير جيني مهم. تحمي التيلوميرات نهايات الكروموسومات من التدهور أثناء انقسام الخلية . يضمن إنزيم التيلوميراز بقاء الكروموسومات سليمة. يمكن أن يقلل الإجهاد الذهني من نشاط هذا الإنزيم ، مما يؤدي في النهاية إلى تسريع تقصير التيلوميرات في عملية الشيخوخة.
ج أومباريسون لعلم الوراثة
يمكن فهم مصطلح علم التخلق عندما ينظر المرء في عملية الوراثة:
- قبل انقسام الخلية ، تتضاعف المادة الوراثية. ثم يتم نقل نصف الجينوم المضاعف إلى إحدى الخليتين الوليدين. يتم إحضار نصف المادة الوراثية للأم من خلية البويضة بينما يتم إحضار النصف الأب بواسطة خلية الحيوانات المنوية.
- يصف علم الوراثة الجزيئي المادة الوراثية على أنها حلزون مزدوج من خيطين من حمض الديوكسي ريبونوكلييك. تحتوي الخيوط على بوليمر سكر فوسفات-ديوكسيريبوز كعمود فقري. تأتي المعلومات الجينية من تسلسل القواعد الأربعة المرتبطة بالعمود الفقري لسكر الديوكسيريبوز. هذه هي الأدينين (A) والسيتوزين (C) والجوانين (G) والثيمين (T).
- دائمًا ما تقترن قواعد خصلة واحدة بقاعدة مطابقة من الخصلة الثانية. أزواج الأدينين مع الثايمين ، وأزواج السيتوزين مع الجوانين.
- وترتكز المعلومات الجينية بترتيب اللبنات الأساسية A ، C ، G ، T (التسلسل الأساسي).
لا يمكن تفسير بعض ظواهر الوراثة بنموذج الحمض النووي الموصوف للتو:
- أثناء تمايز الخلايا ، تتشكل الخلايا الوليدة ذات الوظيفة المختلفة في سياق انقسام الخلية. بعد تمايز الخلايا ، لا تزال أنواع الخلايا المختلفة تحتفظ بتسلسل الحمض النووي المتماثل. تحديد الهوية الوظيفية للخلية هو موضوع علم التخلق.
- هناك سمات “موروثة” فقط من الأب أو الأم ولا علاقة لها بالحمض النووي. الاضطرابات في هذه الحالة تؤدي إلى أمراض خطيرة.
- عندما يتم تحويل الخلايا المتمايزة مرة أخرى إلى خلايا جذعية ، يجب إزالة الأنماط اللاجينية. يمكن للخلية مرة أخرى أن تكتسب وترث جميع الوظائف أو العديد منها عند إزالة التثبيتات اللاجينية.
الهستونات ودورها في التثبيت اللاجيني
لا يوجد الحمض النووي عارياً في نواة الخلية ، ولكنه مرتبط بالهيستونات. تشكل ثمانية بروتينات هيستون مختلفة نواة جسيم نووي يتم فيها تجرح 146 زوجًا أساسيًا من خيط DNA. تبرز نهايات خيوط الهيستون من النواة وهي هدف إنزيمات معدلة للهيستون.
تعديلات هيستون هي أساسًا مثيلة وأستلة على ليسين أو هيستيدين أو أرجينين ، بالإضافة إلى الفسفرة على السيرينات. كما أنه يلعب دورًا سواء كانت السلسلة الجانبية لليسين مشغولة بمجموعة واحدة أو مجموعتين أو ثلاث مجموعات ميثيل. قد يكون نوع من “كود هيستون” مرتبطًا بنشاط الجينات المرتبطة بالهيستونات.

تأثير الميثلة والأستلة على تشكيل الكروماتين
التغييرات في سلاسل جانبية هيستون تغير حجم قطعة الجينات. توجد أحجام أصغر من المقاطع الجينية ذات التشكل المغلق ، جنبًا إلى جنب مع تكاثف الكروموسوم وتعطيل الجين. يمكن ملاحظة أحجام أكبر من شرائح الجينات في التشكل المفتوح جنبًا إلى جنب مع النشاط الجيني. يحدث الانتقال بين الحالتين بسبب ارتباط وانقسام مجموعات الميثيل بقواعد السيتوزين.
بشكل عام ، يؤدي ارتباط مجموعات الأسيتيل بالهيستونات إلى فتح التشكل النووي. هذا الفتح يجعل الجين متاحًا للنسخ بواسطة بوليميراز RNA. يؤدي ارتباط مجموعات الميثيل بسلاسل جانبية ليسين إلى ارتباط بروتين MeCB المرتبط بالميثيل الذي يقمع التعبير الجيني. تغلق هذه البروتينات المثبطة لتشكل الهيستون ، مما يمنع النسخ.
التغيرات اللاجينية في مسار الحياة
لا يقتصر علم التخلق الوراثي على حالات الوراثة. يتم إيلاء اهتمام متزايد للعلاقة بين التغييرات المستمرة في مسار الحياة وتطور الأمراض. على سبيل المثال ، يُظهر التوائم المتطابقون درجة عالية من التشابه اللاجيني في سن الثالثة ولكن ليس في سن الخمسين. كانت درجة المثيلة أعلى بمقدار 2.5 مرة في توأم واحد.
وهكذا ، على الرغم من هويتهم الجينية ، فإن التوائم الأكبر سناً تكون أكثر تنوعًا من الناحية اللاجينية كلما كان مسار حياة التوائم أكثر اختلافًا. ليس فقط البيئة التي يواجهونها هي التي تسبب هذا ، ولكن أيضًا عدم دقة انتقال أنماط مجموعة الميثيل أثناء كل انقسام للخلية. وبالتالي ، فإن التغييرات التدريجية تضيف المزيد والمزيد على مدار العمر.
يؤدي تغيير النظام الغذائي لدى النحل العامل إلى إعادة برمجة عالية الوراثة لجينوم اليرقات. تم تحديد أكثر من 500 جين تأثرت بالتغيرات البيئية التي تحدث في المثيلة.
إن تنشيط أو عدم تنشيط الجينات ليس هو النتيجة الوحيدة لتغيير النظام الغذائي. هناك أيضًا تضفير بديل ومنتجات جينية متغيرة.
التغيرات اللاجينية كتفسير للأمراض
تفسير عوامل الإجهاد هو التركيز الرئيسي للبحوث اللاجينية. تم استخدام الأفراد الذين يعانون من تجارب حياة مؤلمة مبكرة ، بسبب نقص رعاية الأمومة ، لهذا الغرض. يؤدي الإجهاد إلى سلسلة من الهرمونات تبدأ في منطقة ما تحت المهاد ، وهي جزء من الدماغ البيني.
لقد ثبت أن جين الجلوكوكورتيكويد يظهر ميثيلات مختلفة بشكل لافت للنظر في الأفراد المعنيين. وفقًا لذلك ، يتم تثبيط الجين في وجود تاريخ من الإجهاد. المنتج الجيني في قشرة الغدة الكظرية ، المحطة النهائية لسلسلة الهرمونات ، يختلف فيما بعد. يتم تنظيم أكثر من 900 جينة في الدماغ نتيجة لسلوك الأم.
كما تم تأكيد النتائج على البشر. إن جين المستقبل في الحُصين عند البشر مطابق إلى حد كبير لجين الثدييات الأخرى. لذلك فإن التغيرات فوق الجينية تشبه تلك التي تحدث في الفئران.
قسمت دراسة أجريت على مرشحين للانتحار الأشخاص المتضررين إلى مجموعتين ، أولئك الذين تعرضوا لتجربة إساءة معاملة في مرحلة الطفولة وأولئك الذين لا يعانون منها. فقط في المرشحين الذين لديهم تاريخ من سوء المعاملة تم حظر جين المستقبل بالمثيلة.
يمكن أن يكون للصدمة التي تتعرض لها الأم أثناء الحمل عواقب دائمة على الطفل الحامل تستمر لعقود. هناك زيادة كبيرة في خطر الإصابة بالفصام وأمراض القلب لدى الأطفال من الأمهات اللائي عانين من المجاعة. وقد لوحظ أيضًا أن هؤلاء الأطفال يحملون تغييرات في نمط المثيلة لجين Igf2.
في الفئران ، يغير استهلاك الكوكا المنتظم من النمط اللاجيني لعدة مئات من الجينات في مركز المكافأة في الدماغ. هذا يزيد من الحساسية لتأثيرات الأدوية ويزيد من خطر الإدمان.
حجم التغيرات اللاجينية على مدى العمر أكبر بعدة مرات من الطفرات الجينية. قد يوفر إجابات جديدة لمجموعة متنوعة من الأمراض مثل الفصام ، والزهايمر ، والسرطان ، ومرض السكري الذي يصيب البالغين ، والاضطرابات العصبية ، وغيرها الكثير.
وراثة البصمات اللاجينية
النتائج المتعلقة بالتعديلات اللاجينية ، خاصة في العلوم الشعبية ، ترسم باستمرار أوجه شبه مع اللاماركية. يُنظر إلى اللاماركية ، أو انتقال الشخصيات المكتسبة ، على أنها متناقضة مع علم الوراثة الكلاسيكي.
ومع ذلك ، هناك القليل من الأدلة على أن القدرات المكتسبة والمكتسبة يمكن أن تنتقل عبر الخلايا الجرثومية. إن نقل القدرات المكتسبة إلى الجيل التالي ليس دليلاً بعد على المظهر الجيني. أيضًا ، غالبًا ما يُساء تفسير مصطلح “جيل” على أنه بداية دورة فردية.
تم اقتراح وراثة البصمات اللاجينية في عام 2003 من قبل راندي جيرتل وروبرت ووترلاند باستخدام تجارب الفئران. تم إعطاء إناث الفئران agouti تركيبة معينة من العناصر الغذائية قبل التزاوج وأثناء الحمل. وجد أن نسبة كبيرة من النسل لم تظهر النمط الظاهري النموذجي.
في دراسة الإنسان ، العوامل المختلفة التي قدمت المعلومات حول توافر الغذاء ومعدلات الوفيات في بلدة Överkalix السويدية الصغيرة . وجد أن معظم الأشخاص الذين عانى أجدادهم من تغيرات غذائية حادة قد أصيبوا بأمراض القلب والأوعية الدموية مع تقدمهم في السن.
ومع ذلك ، فقد اتبع المرض نمطًا معينًا ، مما يشير إلى حدوث تغيرات جينية في الكروموسومات الجنسية. على سبيل المثال ، في العائلات التي كان الجد يأكل فيها جيدًا أو يأكل كثيرًا ، تأثر الأحفاد الذكور فقط.
وفقًا لفرضية كتبها ويليام آر رايس وزملاؤه ، قد يكون علم التخلق هو سبب الشذوذ الجنسي البشري . ينتقل التفضيل الجنسي للأم إلى الابن وتفضيل الأب على الابنة.
سيحدث هذا إذا تم الاحتفاظ بالعلامات اللاجينية على الجينات المسؤولة عن التوجه الجنسي في الخلايا الجرثومية. إذا لم تتم إزالة العلامات اللاجينية من خلية البويضة ، يمكن أن يكون للجنين التوجه الجنسي للأم. وفقًا لهذه الفرضية ، فإن المثلية الجنسية لدى البشر فطرية.
تشرح الفرضية سبب استمرار حدوث المثلية الجنسية لدى البشر من الناحية الإحصائية مع مرور الوقت. ومع ذلك ، لا يوجد دليل تجريبي على وجود علاقة بين المثلية الجنسية وعلم التخلق.
