エピジェネティクスとは何ですか?
エピジェネティクスは、の活動を決定する要因の研究です遺伝子人間の中でゲノム。 それは、の変化に基づかない遺伝子機能の変化を伴いますDNAシーケンスが娘細胞に渡されます。
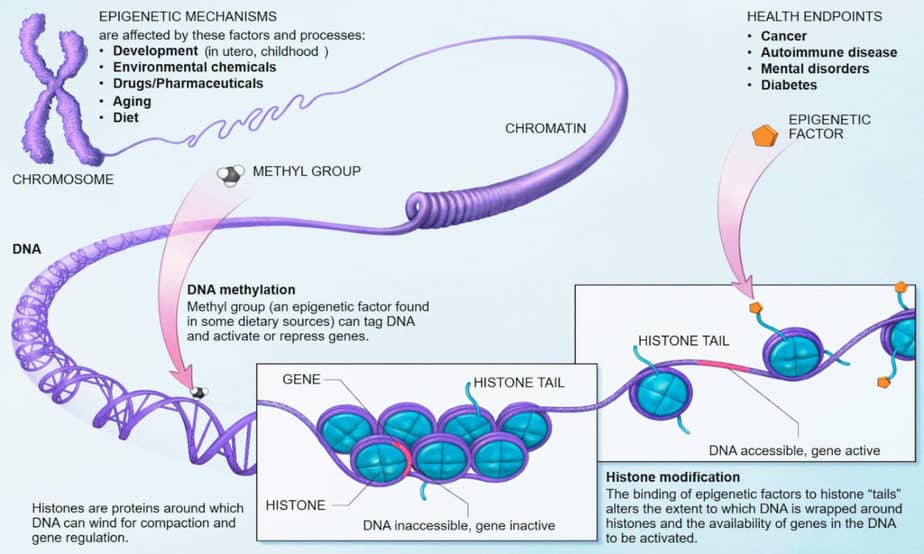
エピジェネティクスの基礎は、クロマチンの化学変化です。 DNAに結合するタンパク質やDNA自体に影響を与える可能性があります。 これらの変化は、セクションまたは染色体全体の活動に影響を与える可能性があります。 これは、エピジェネティックな変化またはエピジェネティックな刷り込みとも呼ばれます。
DNA配列は変更されていないため、DNA配列からエピジェネティックな修飾を検出することはできません。 エピジェネティックなプロセスの種類には、X染色体の不活性化、遺伝子の刷り込み、または細胞の転写記憶の保存が含まれます。
Christina Swords、Ph.D。が編集
エピジェネティクスの基礎
受精後、卵細胞は分裂します。 8セルの段階まで、すべての娘セルは同じです。 それらはそれぞれがそれ自体で完全な生物を生産することができるので、全能性と呼ばれます。
この段階の後、異なる内部プログラムを持つセルがあります。 これらの細胞は、ますます特殊化するにつれて、開発の可能性が制限されます。
体が完全に形成されると、ほとんどの体細胞は、エピジェネティックなメカニズムに基づいて機能するようにしっかりとプログラムされます。 DNAの塩基またはDNAをパッケージングするヒストン、あるいはその両方の生化学的修飾により、機能が修正されました。 遺伝物質の配列は、いくつかのランダムな突然変異を除いて変更されていません。
このようなエピジェネティックな修飾により、ゲノムの特定の領域が「サイレンシング」されます。つまり、簡単に転写することができません。 RNAタンパク質合成用。 これらの修飾は、体細胞では幹細胞や生殖細胞とはかなり異なって見えます。 最も重要な修飾は、シトシン塩基のメチル化と、ヒストンの側鎖メチル化およびアセチル化です。
メチル化に加えて、テロメアは重要なエピジェネティックな影響を及ぼします。 テロメアは染色体の末端を分解から保護します細胞分裂。 酵素テロメラーゼは、染色体が無傷のままであることを保証します。 精神的ストレスはこの酵素の活性を低下させる可能性があり、最終的には老化過程でテロメアの短縮が加速します。
C omparison遺伝学へ
エピジェネティクスという用語は、継承のプロセスを考えると理解できます。
- 細胞が分裂する前に、遺伝物質は2倍になります。 次に、複製されたゲノムの半分が2つの娘細胞の1つに移されます。 母体の遺伝物質の半分は卵細胞によって運ばれ、父方の半分は精子細胞によって運ばれます。
- 分子遺伝学は、遺伝物質を2つのデオキシリボ核酸鎖の二重らせんとして説明します。 ストランドは、バックボーンとしてリン酸-デオキシリボース糖ポリマーを持っています。 遺伝情報は、デオキシリボース糖骨格に結合している4つの塩基の配列に由来します。 それらは、アデニン(A)、シトシン(C)、グアニン(G)、およびチミン(T)です。
- 1つのストランドの塩基は、ほとんどの場合、2番目のストランドの一致する塩基とペアになります。 アデニンはチミンとペアになり、シトシンはグアニンとペアになります。
- 遺伝情報は、ビルディングブロックA、C、G、T(塩基配列)の順序で固定されています。
遺伝のいくつかの現象は、今説明したDNAモデルでは説明できません。
- 細胞分化の過程で、異なる機能を持つ娘細胞が形成されます。 細胞分化後も、異なる細胞タイプは同様のDNA配列を保持します。 細胞の機能的同一性の決定は、エピジェネティクスのトピックです。
- 父親または母親からのみ「受け継がれ」、DNAとは関係のない形質があります。 この状態の乱れは深刻な病気につながります。
- 分化した細胞が幹細胞に戻されるとき、エピジェネティックなパターンを取り除く必要があります。 エピジェネティックな固定が解除されると、細胞は再びすべてまたは多くの機能を獲得して継承することができます。
ヒストンとエピジェネティックな固定におけるそれらの役割
DNAは細胞核に裸で存在するのではなく、ヒストンに結合しています。 8つの異なるヒストンタンパク質がヌクレオソームの核を形成し、その上に146塩基対のDNA鎖が巻かれています。 ヒストン鎖の末端はヌクレオソームから突き出ており、ヒストン修飾酵素の標的です。
ヒストン修飾は、主にリジン、ヒスチジン、またはアルギニンのメチル化とアセチル化、およびセリンのリン酸化です。 また、リジン側鎖が1つ、2つ、または3つのメチル基で占められているかどうかにも影響します。 一種の「ヒストンコード」は、ヒストンによって結合された遺伝子の活動に関連している可能性があります。

クロマチンのコンフォメーションに対するメチル化とアセチル化の影響
ヒストン側鎖の変化は、遺伝子セグメントの体積を変化させます。 染色体の凝縮と遺伝子の不活性化に加えて、閉じたコンフォメーションの遺伝子セグメントの量が少なくなっています。 遺伝子活性とともに、より大量の遺伝子セグメントがオープンコンフォメーションで観察されます。 2つの状態間の遷移は、メチル基のシトシン塩基への結合と切断によって引き起こされます。
一般に、アセチル基がヒストンに結合すると、ヌクレオソームのコンフォメーションが開きます。 この開口部により、遺伝子はRNAポリメラーゼによる転写に利用できるようになります。 メチル基がリジン側鎖に結合すると、遺伝子発現を抑制するメチル結合タンパク質MeCBが結合します。 これらのリプレッサータンパク質はヒストンのコンフォメーションを閉じ、転写を防ぎます。
ライフコースにおけるエピジェネティックな変化
エピジェネティクスは遺伝の場合に限定されません。 ライフコースの継続的な変化と病気の発症との関係にますます注目が集まっています。 たとえば、一卵性双生児は3歳で高度なエピジェネティックな類似性を示しますが、50歳ではありません。 メチル化の程度は、1つの双子で最大2.5倍高かった。
したがって、それらの遺伝的同一性にもかかわらず、古い双子は、双子のライフコースが異なるほど、後成的に多様です。 彼らが経験する環境だけでなく、各細胞分裂中のメチル基パターンの伝達の不正確さもこれを引き起こします。 したがって、段階的な変化は、生涯の間にますます加算されます。
働きバチの食餌の変化は、幼虫のゲノムの高度に後成的な再プログラミングを引き起こします。 環境によって誘発されるメチル化の変化によって影響を受ける500を超える遺伝子が同定されています。
遺伝子の活性化または非活性化は、食事の変化の唯一の結果ではありません。 選択的スプライシングや改変された遺伝子産物もあります。
病気の説明としてのエピジェネティックな変化
ストレス要因の説明は、エピジェネティックな研究の主要な焦点です。 出産ケアの欠如によって引き起こされた初期のトラウマ的な人生経験を持つ個人は、この目的のために使用されてきました。 ストレスは、間脳の一部である視床下部で始まるホルモンのカスケードを引き起こします。
糖質コルチコイド遺伝子は、関係する個人で著しく異なるメチル化を示すことが示されています。 したがって、遺伝子はストレスの履歴の存在下で阻害されます。 ホルモン鎖の末端ステーションである副腎皮質の遺伝子産物は、その後異なります。 母性行動の結果として、900を超える遺伝子が脳内でアップレギュレートまたはダウンレギュレートされます。
結果は人間でも確認されています。 ヒトの海馬の受容体遺伝子は、他の哺乳類の受容体遺伝子とほぼ同じです。 したがって、エピジェネティックな変化はラットの変化と似ています。
自殺候補者を対象とした研究では、影響を受けた人を2つのグループに分けました。子供時代の虐待の経験がある人とない人です。 虐待の歴史を持つ候補者だけが、メチル化によって受容体遺伝子がブロックされました。
妊娠中に母親が経験したトラウマは、妊娠中の子供に何十年も続く永続的な結果をもたらす可能性さえあります。 飢饉に苦しんでいる母親の子供たちの統合失調症と心臓病のリスクが大幅に増加しています。 これらの子供たちは、Igf2遺伝子のメチル化パターンに変化をもたらすことも観察されています。
マウスでは、定期的なコカの消費は、脳の報酬中心にある数百の遺伝子の後成的パターンを変化させます。 これにより、薬の効果に対する感受性が高まり、依存症のリスクが高まります。
生涯にわたるエピジェネティックな変化の大きさは、遺伝子変異のそれよりも何倍も大きい。 統合失調症、アルツハイマー病、癌、成人発症型糖尿病、神経障害など、さまざまな病気に対する新しい答えを提供する可能性があります。
エピジェネティックな痕跡の継承
特にポピュラーサイエンスにおけるエピジェネティックな変化に関する発見は、常にラマルキズムと類似しています。 ラマルキズム、または後天的な性格の通過は、古典遺伝学と矛盾していると見なされています。
しかし、習得した能力が生殖細胞を介して受け継がれるという証拠はほとんどありません。 獲得した能力を次の世代に引き継ぐことは、まだ遺伝的症状の証拠ではありません。 また、「世代」という用語は、個々のサイクルの始まりと誤解されることがよくあります。
エピジェネティックな痕跡の継承は、2003年にRandyJirtleとRobertWaterlandによってマウス実験を使用して提案されました。 雌のアグーチマウスには、交尾前および妊娠中に特定の組成の栄養素を投与しました。 子孫の大部分が典型的な表現型を示さなかったことが見出された。
人間の研究では、情報を提供したさまざまな要因スウェーデンの小さな町エベルカーリクスでの食料の入手可能性と死亡率に関する研究。 祖父母の食事が急激に変化したほとんどの人は、年をとるにつれて心血管疾患を発症することがわかりました。
しかし、この病気は特定のパターンをたどりました。これは、性染色体のエピジェネティックな変化を示唆しています。 たとえば、祖父がよく食べたり食べすぎたりした家族では、男性の孫だけが影響を受けました。
ウィリアムR.ライスと同僚による仮説によると、エピジェネティクスは人間の同性愛の原因かもしれません。 母親の性的嗜好は息子に伝わり、父親の嗜好は娘に伝わります。
これは、性的指向の原因となる遺伝子のエピジェネティックマーカーが生殖細胞に保持されている場合に発生します。 卵細胞のエピジェネティックマークが除去されない場合、胚は母親の性的指向を持つ可能性があります。 この仮説によれば、人間の同性愛は生まれつきのものです。
この仮説は、人間の同性愛の発生が時間の経過とともに統計的に安定している理由を説明しています。 ただし、同性愛とエピジェネティクスの関係についての経験的証拠はありません。
