Qu’est-ce que l’épigénétique?
L’épigénétique est l’étude des facteurs qui déterminent l’activité d’un gène chez l’humain génome . Cela implique des changements dans la fonction des gènes qui ne sont pas basés sur des changements ADN séquences mais transmises aux cellules filles.
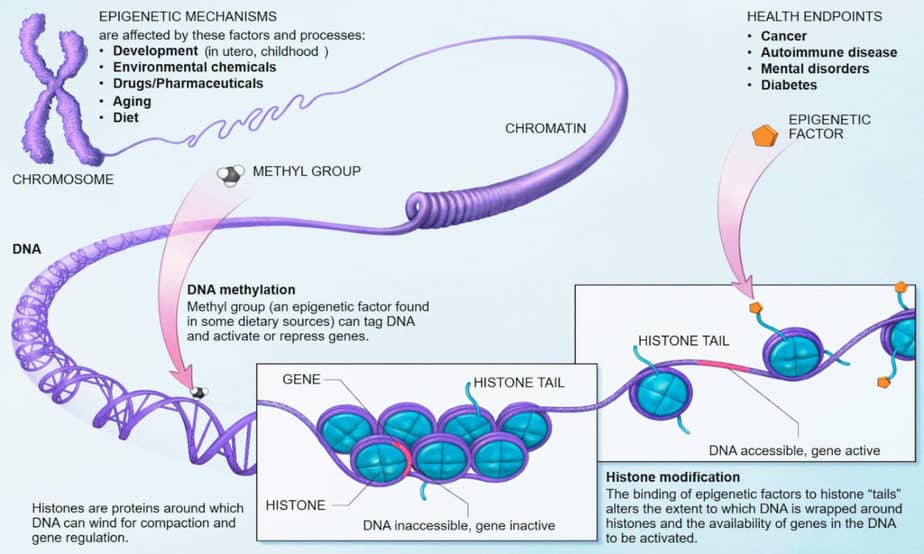
Les changements chimiques de la chromatine sont à la base de l’épigénétique. Cela peut affecter les protéines qui se lient à l’ADN ou l’ADN lui-même. Ces changements peuvent influencer l’activité de sections ou de chromosomes entiers. Ceci est également appelé altération épigénétique ou empreinte épigénétique.
Comme la séquence d’ADN n’est pas modifiée, les modifications épigénétiques ne peuvent pas être détectées à partir de la séquence d’ADN. Les types de processus épigénétiques comprennent l’inactivation des chromosomes X, l’impression d’un gène ou le stockage de la mémoire transcriptionnelle des cellules.
Edité par Christina Swords, Ph.D.
Bases de l’épigénétique
Après la fécondation, l’ovule se divise. Jusqu’au stade 8 cellules, toutes les cellules filles sont égales. Ils sont appelés totipotents car chacun d’eux est encore capable de produire un organisme complet à lui seul.
Après cette étape, il y a des cellules avec un programme interne différent. Ces cellules ont un potentiel de développement limité car elles deviennent de plus en plus spécialisées.
Lorsque le corps est complètement formé, la plupart des cellules du corps sont fermement programmées pour leur fonction basée sur des mécanismes épigénétiques. La fonction a été fixée en raison de modifications biochimiques des bases de l’ADN ou des histones emballant l’ADN, ou des deux. La séquence du matériel génétique reste inchangée à l’exception de quelques mutations aléatoires.
De telles modifications épigénétiques conduisent à ce que certaines régions du génome soient « silencieuses », c’est-à-dire qu’elles ne peuvent pas être facilement transcrites en ARN pour la synthèse des protéines. Ces modifications sont assez différentes dans les cellules somatiques et dans les cellules souches ou dans les cellules germinales. Les modifications les plus importantes sont la méthylation des bases de cytosine et la méthylation et l’acétylation de la chaîne latérale des histones.
Outre la méthylation, les télomères ont une influence épigénétique importante. Les télomères protègent les extrémités des chromosomes de la dégradation pendant la division cellulaire . L’enzyme télomérase garantit que les chromosomes restent intacts. Le stress mental peut réduire l’activité de cette enzyme, ce qui a finalement conduit à un raccourcissement accéléré des télomères dans le processus de vieillissement.
C omparaison à la génétique
Le terme épigénétique peut être compris quand on considère le processus d’hérédité:
- Avant qu’une cellule ne se divise, le matériel génétique est doublé. La moitié du génome dupliqué est ensuite transférée dans l’une des deux cellules filles. La moitié du matériel génétique maternel est apportée par l’ovule tandis que la moitié paternelle par le spermatozoïde.
- La génétique moléculaire décrit le matériel génétique comme une double hélice de deux brins d’acide désoxyribonucléique. Les brins ont un polymère de sucre phosphate-désoxyribose comme squelette. L’information génétique provient de la séquence des quatre bases qui sont attachées au squelette du sucre de désoxyribose. Ce sont l’adénine (A), la cytosine (C), la guanine (G) et la thymine (T).
- Les bases d’un brin s’apparient presque toujours avec une base correspondante du deuxième brin. L’adénine s’apparie à la thymine et la cytosine se couple à la guanine.
- L’information génétique est ancrée dans l’ordre des blocs de construction A, C, G, T (la séquence de base).
Certains phénomènes d’hérédité ne peuvent pas être expliqués avec le modèle d’ADN qui vient d’être décrit:
- Au cours de la différenciation cellulaire, des cellules filles ayant une fonction différente sont formées au cours de la division cellulaire. Après la différenciation cellulaire, différents types de cellules conservent toujours des séquences d’ADN similaires. La détermination de l’identité fonctionnelle d’une cellule est un sujet d’épigénétique.
- Il existe des traits qui ne sont « hérités » que du père ou de la mère et qui ne sont pas liés à l’ADN. Les perturbations de cet état conduisent à des maladies graves.
- Lorsque les cellules différenciées sont reconverties en cellules souches, les motifs épigénétiques doivent être supprimés. Une cellule peut à nouveau acquérir et hériter de toutes ou de nombreuses fonctions lorsque les fixations épigénétiques sont supprimées.
Les histones et leur rôle dans la fixation épigénétique
L’ADN n’est pas présent nu dans le noyau cellulaire, mais est lié aux histones. Huit protéines histones différentes forment le noyau d’un nucléosome sur lequel sont enroulées 146 paires de bases d’un brin d’ADN. Les extrémités des brins d’histone dépassent du nucléosome et sont la cible d’enzymes modifiant l’histone.
Les modifications de l’histone sont principalement la méthylation et l’acétylation sur la lysine, l’histidine ou l’arginine, ainsi que les phosphorylations sur les sérines. Le fait que la chaîne latérale de la lysine soit occupée par un, deux ou trois groupes méthyle joue également un rôle. Une sorte de « code d’histone » peut être liée à l’activité des gènes liés par les histones.

Influence de la méthylation et de l’acétylation sur la conformation de la chromatine
Les changements dans les chaînes latérales des histones modifient le volume d’un segment de gène. Il existe de plus petits volumes de segments de gènes en conformation fermée, ainsi que la condensation chromosomique et l’inactivation des gènes. Des volumes plus importants de segments géniques peuvent être observés en conformation ouverte avec l’activité génique. La transition entre les deux états est causée par l’attachement et le clivage des groupes méthyle aux bases cytosine.
En général, l’attachement de groupes acétyle aux histones conduit à l’ouverture de la conformation du nucléosome. Cette ouverture rend le gène disponible pour la transcription par l’ARN polymérase. L’attachement de groupes méthyle aux chaînes latérales de la lysine conduit à l’attachement de la protéine de liaison au méthyle MeCB qui supprime l’expression génique. Ces protéines répressives ferment la conformation de l’histone, empêchant la transcription.
Changements épigénétiques au cours de la vie
L’épigénétique ne se limite pas aux cas d’hérédité. Une attention croissante est accordée au lien entre les changements en cours dans le cours de la vie et le développement de maladies. Par exemple, des jumeaux identiques présentent un degré élevé de similitude épigénétique à l’âge de trois ans mais pas à 50 ans. Le degré de méthylation était jusqu’à 2,5 fois plus élevé chez un jumeau.
Ainsi, malgré leur identité génétique, les jumeaux plus âgés sont épigénétiquement plus diversifiés, plus le parcours de vie des jumeaux est différent. Non seulement l’environnement qu’ils vivent en est la cause, mais aussi l’imprécision de la transmission des modèles de groupe méthyle au cours de chaque division cellulaire. Les changements progressifs s’additionnent donc de plus en plus au cours d’une vie.
Le changement de régime alimentaire des abeilles ouvrières entraîne une reprogrammation très épigénétique du génome larvaire. Plus de 500 gènes ont été identifiés qui sont affectés par les changements de méthylation induits par l’environnement.
L’activation ou la non-activation des gènes n’est pas la seule conséquence d’un changement alimentaire. Il existe également des épissures alternatives et des produits géniques modifiés.
Les changements épigénétiques comme explication des maladies
L’explication des facteurs de stress est un axe majeur de la recherche épigénétique. Des personnes ayant des expériences de vie traumatisantes précoces, déclenchées par le manque de soins de maternité, ont été utilisées à cette fin. Le stress déclenche une cascade d’hormones qui commence dans l’hypothalamus, une partie du diencéphale.
Il a été démontré qu’un gène glucocorticoïde présente des méthylations remarquablement différentes chez les individus concernés. En conséquence, le gène est inhibé en présence d’antécédents de stress. Le produit du gène dans le cortex surrénalien, la station terminale de la chaîne hormonale, est par la suite différent. Plus de 900 gènes sont régulés à la hausse ou à la baisse dans le cerveau en raison du comportement maternel.
Les résultats ont également été confirmés chez l’homme. Le gène récepteur de l’hippocampe chez l’homme est largement identique à celui des autres mammifères. Les changements épigénétiques sont donc similaires à ceux observés chez le rat.
Une étude menée auprès de candidats au suicide a divisé les personnes touchées en deux groupes, celles qui ont vécu des abus pendant l’enfance et celles qui n’en ont pas. Ce n’est que chez les candidats ayant des antécédents d’abus que le gène récepteur a été bloqué par méthylation.
Un traumatisme vécu par la mère pendant la grossesse peut même avoir des conséquences durables pour le futur enfant qui durent des décennies. Il y a une augmentation significative du risque de schizophrénie et de maladie cardiaque chez les enfants de mères qui ont souffert de la famine. On a également observé que ces enfants portaient des changements dans le schéma de méthylation du gène Igf2.
Chez la souris, la consommation régulière de coca modifie le schéma épigénétique de plusieurs centaines de gènes dans le centre de récompense du cerveau. Cela augmente la sensibilité aux effets des drogues et augmente le risque de dépendance.
L’ampleur des changements épigénétiques au cours d’une vie est plusieurs fois supérieure à celle des mutations génétiques. Il peut apporter de nouvelles réponses à une variété de maladies telles que la schizophrénie, la maladie d’Alzheimer, le cancer, le diabète de l’adulte, les troubles nerveux et bien d’autres.
Héritage des empreintes épigénétiques
Les découvertes sur les altérations épigénétiques, en particulier dans la science populaire, établissent constamment des parallèles avec le lamarckisme. Le lamarckisme, ou le passage de caractères acquis, est considéré comme contradictoire à la génétique classique.
Cependant, il y a très peu de preuves que les capacités apprises et acquises peuvent être transmises via les cellules germinales. La transmission des capacités acquises à la génération suivante n’est pas encore une preuve de manifestation génétique. De plus, le terme «génération» est souvent mal interprété comme le début d’un cycle individuel.
Un héritage des empreintes épigénétiques a été proposé en 2003 par Randy Jirtle et Robert Waterland à l’aide d’expériences sur souris. Des souris femelles agouti ont reçu une certaine composition de nutriments avant l’accouplement et pendant la grossesse. Il a été constaté qu’une grande proportion de la progéniture ne présentait pas le phénotype typique.
Dans une étude humaine, divers facteurs qui ont fourni des informations sur la disponibilité alimentaire et la mortalité dans la petite ville suédoise d’Överkalix . Il a été constaté que la plupart des personnes dont les grands-parents avaient des changements alimentaires brusques développaient des maladies cardiovasculaires en vieillissant.
Cependant, la maladie a suivi un certain schéma, ce qui suggère des changements épigénétiques sur les chromosomes sexuels. Par exemple, dans les familles où le grand-père avait bien mangé ou trop mangé, seuls les petits-enfants mâles étaient concernés.
Selon une hypothèse de William R. Rice et de ses collègues, l’épigénétique peut être la cause de l’homosexualité humaine . La préférence sexuelle de la mère serait transmise au fils et la préférence du père à la fille.
Cela se produirait si les marqueurs épigénétiques sur les gènes responsables de l’orientation sexuelle étaient retenus dans les cellules germinales. Si les marques épigénétiques dans l’ovule ne sont pas supprimées, l’embryon peut avoir l’orientation sexuelle de la mère. Selon cette hypothèse, l’homosexualité chez l’homme est innée.
L’hypothèse explique pourquoi l’occurrence de l’homosexualité chez l’homme reste statistiquement stable dans le temps. Cependant, il n’y a aucune preuve empirique d’un lien entre l’homosexualité et l’épigénétique.
