¿Qué es la epigenética?
La epigenética es el estudio de factores que determinan la actividad de un gene en el humano genoma . Implica cambios en la función genética que no se basan en cambios en ADN secuencias pero pasadas a las células hijas.
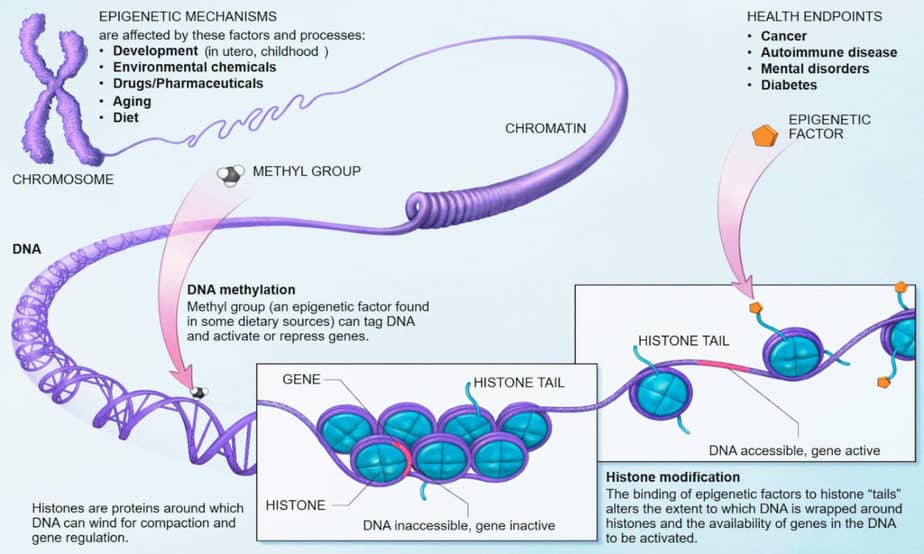
La base de la epigenética son los cambios químicos en la cromatina. Puede afectar las proteínas que se unen al ADN o al ADN mismo. Estos cambios pueden influir en la actividad de secciones o cromosomas completos. Esto también se conoce como alteración epigenética o impronta epigenética.
Como la secuencia de ADN no cambia, las modificaciones epigenéticas no pueden detectarse a partir de la secuencia de ADN. Los tipos de procesos epigenéticos incluyen inactivar los cromosomas X, imprimir genes o almacenar la memoria transcripcional de las células.
Editado por Christina Swords, Ph.D.
Conceptos básicos de la epigenética
Después de la fertilización, el óvulo se divide. Hasta la etapa de 8 células, todas las células hijas son iguales. Se les llama totipotentes porque cada uno de ellos todavía es capaz de producir un organismo completo por sí solo.
Después de esta etapa, hay células con un programa interno diferente. Estas células tienen un potencial de desarrollo limitado a medida que se vuelven cada vez más especializadas.
Cuando el cuerpo está completamente formado, la mayoría de las células del cuerpo están firmemente programadas para su función basándose en mecanismos epigenéticos. La función se fijó debido a modificaciones bioquímicas de las bases en el ADN o de las histonas que empaquetaban el ADN, o ambos. La secuencia del material genético se mantiene sin cambios, salvo algunas mutaciones aleatorias.
Tales modificaciones epigenéticas dan como resultado que ciertas regiones del genoma sean «silenciadas», es decir, no se pueden transcribir fácilmente a ARN para la síntesis de proteínas. Estas modificaciones se ven bastante diferentes en las células somáticas que en las células madre o en las células germinales. Las modificaciones más importantes son la metilación de las bases de citosina y la metilación y acetilación de las cadenas laterales de las histonas.
Además de la metilación, los telómeros tienen una importante influencia epigenética. Los telómeros protegen los extremos de los cromosomas de la degradación durante división celular . La enzima telomerasa asegura que los cromosomas permanezcan intactos. El estrés mental puede reducir la actividad de esta enzima, lo que finalmente conduce a un acortamiento acelerado de los telómeros en el proceso de envejecimiento.
C comparación a la genética
El término epigenética se puede entender cuando se considera el proceso de herencia:
- Antes de que una célula se divida, el material genético se duplica. La mitad del genoma duplicado se transfiere luego a una de las dos células hijas. La mitad del material genético materno es aportado por el óvulo mientras que la mitad paterna por el espermatozoide.
- La genética molecular describe el material genético como una doble hélice de dos hebras de ácido desoxirribonucleico. Las hebras tienen polímero de azúcar fosfato-desoxirribosa como columna vertebral. La información genética proviene de la secuencia de las cuatro bases que están unidas a la columna vertebral del azúcar desoxirribosa. Estos son adenina (A), citosina (C), guanina (G) y timina (T).
- Las bases de una hebra casi siempre se emparejan con una base coincidente de la segunda hebra. La adenina se empareja con la timina y la citosina se empareja con la guanina.
- La información genética está anclada en el orden de los bloques de construcción A, C, G, T (la secuencia de bases).
Algunos fenómenos de la herencia no se pueden explicar con el modelo de ADN que acabamos de describir:
- Durante la diferenciación celular, se forman células hijas con una función diferente en el curso de la división celular. Después de la diferenciación celular, los diferentes tipos de células aún conservan secuencias de ADN similares. La determinación de la identidad funcional de una célula es un tema de epigenética.
- Hay rasgos que solo se «heredan» del padre o de la madre y no están relacionados con el ADN. Las alteraciones de este estado conducen a enfermedades graves.
- Cuando las células diferenciadas se transforman nuevamente en células madre, se deben eliminar los patrones epigenéticos. Una célula puede volver a adquirir y heredar todas o muchas funciones cuando se eliminan las fijaciones epigenéticas.
Histonas y su papel en la fijación epigenética
El ADN no está presente desnudo en el núcleo celular, sino que está unido a las histonas. Ocho proteínas histonas diferentes forman el núcleo de un nucleosoma en el que se enrollan 146 pares de bases de una hebra de ADN. Los extremos de las cadenas de histonas sobresalen del nucleosoma y son el objetivo de las enzimas modificadoras de histonas.
Las modificaciones de histonas son principalmente metilación y acetilación de lisina, histidina o arginina, así como fosforilaciones de serinas. También influye si la cadena lateral de lisina está ocupada por uno, dos o tres grupos metilo. Una especie de «código de histonas» puede estar relacionado con la actividad de los genes unidos por las histonas.

Influencia de la metilación y acetilación en la conformación de la cromatina
Los cambios en las cadenas laterales de las histonas cambian el volumen de un segmento de gen. Hay volúmenes más pequeños de segmentos de genes en conformación cerrada, junto con condensación de cromosomas e inactivación de genes. Se pueden observar mayores volúmenes de segmentos génicos en conformación abierta junto con actividad génica. La transición entre los dos estados es causada por la unión y escisión de grupos metilo a bases de citosina.
En general, la unión de grupos acetilo a las histonas conduce a la apertura de la conformación del nucleosoma. Esta apertura hace que el gen esté disponible para la transcripción por la ARN polimerasa. La unión de grupos metilo a cadenas laterales de lisina conduce a la unión de la proteína de unión a metilo MeCB que suprime la expresión génica. Estas proteínas represoras cierran la conformación de la histona, impidiendo la transcripción.
Cambios epigenéticos en el curso de la vida.
La epigenética no se limita a los casos de herencia. Se está prestando cada vez más atención a la conexión entre los cambios en curso en el curso de la vida y el desarrollo de enfermedades. Por ejemplo, los gemelos idénticos muestran un alto grado de similitud epigenética a la edad de tres años pero no a los 50. El grado de metilación fue hasta 2,5 veces mayor en un gemelo.
Por lo tanto, a pesar de su identidad genética, los gemelos mayores son epigenéticamente más diversos cuanto más diferente es el curso de vida de los gemelos. No solo el entorno que experimentan causa esto, sino también la inexactitud de la transmisión de patrones de grupos metilo durante cada división celular. Por tanto, los cambios graduales se suman cada vez más a lo largo de la vida.
El cambio de dieta en las abejas obreras provoca una reprogramación altamente epigenética del genoma larvario. Se han identificado más de 500 genes que se ven afectados por los cambios de metilación inducidos por el medio ambiente.
La activación o no activación de genes no es la única consecuencia del cambio dietético. También hay productos genéticos alterados y empalmes alternativos.
Cambios epigenéticos como explicación de enfermedades.
La explicación de los factores de estrés es un enfoque importante de la investigación epigenética. Se ha utilizado con este fin a personas con experiencias traumáticas tempranas de la vida, provocadas por la falta de atención de maternidad. El estrés desencadena una cascada de hormonas que comienza en el hipotálamo, una parte del diencéfalo.
Se ha demostrado que un gen de glucocorticoide muestra metilaciones sorprendentemente diferentes en los individuos afectados. En consecuencia, el gen se inhibe en presencia de un historial de estrés. El producto génico en la corteza suprarrenal, la estación terminal de la cadena hormonal, es posteriormente diferente. Más de 900 genes están regulados hacia arriba o hacia abajo en el cerebro como resultado del comportamiento materno.
Los resultados también se han confirmado en humanos. El gen del receptor en el hipocampo en humanos es en gran parte idéntico al de otros mamíferos. Por tanto, los cambios epigenéticos son similares a los de las ratas.
Un estudio con candidatos al suicidio dividió a las personas afectadas en dos grupos, aquellos con experiencias de abuso infantil y aquellos sin él. Solo en los candidatos con antecedentes de abuso se bloqueó el gen receptor con metilación.
Un trauma experimentado por la madre durante el embarazo puede incluso tener consecuencias duraderas para el futuro hijo que durarán décadas. Existe un aumento significativo en el riesgo de esquizofrenia y enfermedades cardíacas en los niños de madres que sufrieron hambruna. También se ha observado que estos niños portan cambios en el patrón de metilación del gen Igf2.
En ratones, el consumo regular de coca cambia el patrón epigenético de varios cientos de genes en el centro de recompensa del cerebro. Esto aumenta la sensibilidad a los efectos de las drogas y aumenta el riesgo de adicción.
La magnitud de los cambios epigenéticos a lo largo de la vida es muchas veces mayor que la de las mutaciones genéticas. Puede proporcionar nuevas respuestas a una variedad de enfermedades como la esquizofrenia, el Alzheimer, el cáncer, la diabetes de inicio en la edad adulta, los trastornos nerviosos y muchas más.
Herencia de huellas epigenéticas
Los hallazgos sobre alteraciones epigenéticas, especialmente en la ciencia popular, están constantemente trazando paralelos con el lamarckismo. El lamarckismo, o el paso de caracteres adquiridos, se considera contradictorio con la genética clásica.
Sin embargo, hay muy poca evidencia de que las habilidades aprendidas y adquiridas puedan transmitirse a través de las células germinales. La transmisión de las habilidades adquiridas a la siguiente generación aún no es una prueba de manifestación genética. Además, el término «generación» a menudo se malinterpreta como el comienzo de un ciclo individual.
Randy Jirtle y Robert Waterland propusieron una herencia de huellas epigenéticas en 2003 utilizando experimentos con ratones. A los ratones hembra agutí se les administró una determinada composición de nutrientes antes del apareamiento y durante el embarazo. Se encontró que una gran proporción de la descendencia no exhibía el fenotipo típico.
En un estudio en humanos, varios factores que proporcionaron información sobre la disponibilidad de alimentos y la mortalidad en la pequeña ciudad sueca de Överkalix . Se encontró que la mayoría de las personas cuyos abuelos tuvieron cambios dietéticos bruscos desarrollaron enfermedades cardiovasculares a medida que envejecían.
Sin embargo, la enfermedad siguió un patrón determinado, lo que sugiere cambios epigenéticos en los cromosomas sexuales. Por ejemplo, en las familias donde el abuelo había comido bien o comido demasiado, solo los nietos varones se vieron afectados.
Según una hipótesis de William R. Rice y sus colegas, la epigenética puede ser la causa de la homosexualidad humana . La preferencia sexual de la madre se transmitiría al hijo y la preferencia del padre a la hija.
Esto sucedería si los marcadores epigenéticos de los genes responsables de la orientación sexual se mantuvieran en las células germinales. Si no se eliminan las marcas epigenéticas del óvulo, el embrión puede tener la orientación sexual de la madre. Según esta hipótesis, la homosexualidad en humanos es innata.
La hipótesis explica por qué la ocurrencia de la homosexualidad en humanos permanece estadísticamente estable a lo largo del tiempo. Sin embargo, no hay evidencia empírica de una conexión entre la homosexualidad y la epigenética.
