تقرير الحمض النووي لجينوم السديم لـ ALS
هل ALS وراثي؟ أنشأنا تقرير الحمض النووي استنادًا إلى دراسة حاولت الإجابة على هذا السؤال. أدناه يمكنك رؤية تقرير SAMPLE DNA. للحصول على تقرير الحمض النووي الشخصي الخاص بك ، قم بشراء تسلسل الجينوم الكامل !

معلومة اضافية
ما هو ALS؟ (الجزء 1 من هل ALS وراثي؟)
التصلب الجانبي الضموري (ALS) ينتمي إلى مجموعة أمراض الخلايا العصبية الحركية وهو مرض تنكسي نادر يصيب الجهاز العصبي الحركي. إنه يؤثر سلبًا على الأعصاب والخلايا العصبية الحركية. وبالتالي ، فإن أي نشاط يتطلب استخدام العضلات الإرادية ، مثل المشي أو التحدث أو المضغ ، يضعف تدريجياً بمرور الوقت في هذا المرض. هذا يؤدي إلى تقييد تدريجي في أنشطة الحياة اليومية. على الرغم من عدم وجود علاج لـ ALS ، يمكن إبطاء سرعة تقدم المرض.
الأسماء الأخرى للمرض هي متلازمة لو جيريج أو مرض شاركو. كان الأخير هو الواصف للحالة ، جان مارتن شاركو. لو جيريج كان لاعب بيسبول في نيويورك يانكيز واضطر إلى التقاعد بعد تشخيص إصابته بمرض التصلب الجانبي الضموري. جعل مصير جيريج هذا المرض النادر معروفًا للجمهور لأول مرة. كان لتحدي دلو الثلج الشهير من عام 2014 دورًا أساسيًا في جمع الأموال من أجل أبحاث ALS (مصدر المعلومات: جمعية ALS: تحدي دلو الثلج ).
البحث في الأسباب والعلاجات المحتملة لهذا المرض مستمرة. المنظمات الوطنية مثل معهد تطوير العلاج ALS (TDI) ، ال جمعية ALS ، و ال مراكز السيطرة على الأمراض والوقاية منها (CDC) جميعهم قاموا بتمويل مشاريع في هذا المجال في عام 2020.
علم الأوبئة (الجزء 2 من هل ALS وراثي؟)
اعتبارًا من عام 2014 ، تم إصدار CDC أبلغت عن 16000 حالة إصابة بمرض ALS في الولايات المتحدة. السجل الدقيق فيما يتعلق بإحصاءاته الحديثة جدًا غير معروف كثيرًا. في الولايات المتحدة ، حوالي 5-7 توجد حالات لكل 1،00،000 نسمة. يتم تشخيص المرض أخيرًا في الفئة العمرية 55-75 عامًا. ومع ذلك ، تجدر الإشارة إلى أن هذه الحالة نادرًا ما تؤثر على المرضى الأصغر سنًا الذين تتراوح أعمارهم بين 25 و 35 عامًا. كما أنه أكثر شيوعًا عند الرجال منه لدى النساء (تبلغ نسبة الجنس حوالي 1.5: 1).
النماذج (الجزء 3 من هل ALS وراثي؟)
في المقام الأول هناك ثلاثة رئيسية نماذج من ALS.
ALS المتقطع : يحدث هذا النوع بشكل عشوائي دون أي سبب محتمل. غالبية (90 إلى 95٪) من حالات التصلب الجانبي الضموري متفرقة. يشتبه في أن أ مزيج من العوامل الوراثية والبيئية هي المسؤولة.
عائلي : في الولايات المتحدة ، يظهر الشكل العائلي للمرض في أقلية من الحالات (5 إلى 10٪) ، حيث يرث الناس ALS من أحد أفراد الأسرة. يتم توريث معظم الحالات في نمط جسمي سائد ، مما يعني أن نسخة واحدة من الجين المتغير في كل خلية تكفي لإحداث الاضطراب.
غواماني : لوحظ وجود شكل من أشكال المرض في غوام في سكان غوام حيث كان السبب هو استهلاك نخيل الساغو الكاذبة ، سيكاس ميكرونيزيا.
الفيزيولوجيا المرضية لـ ALS (الجزء 4 من هل ALS وراثي؟)
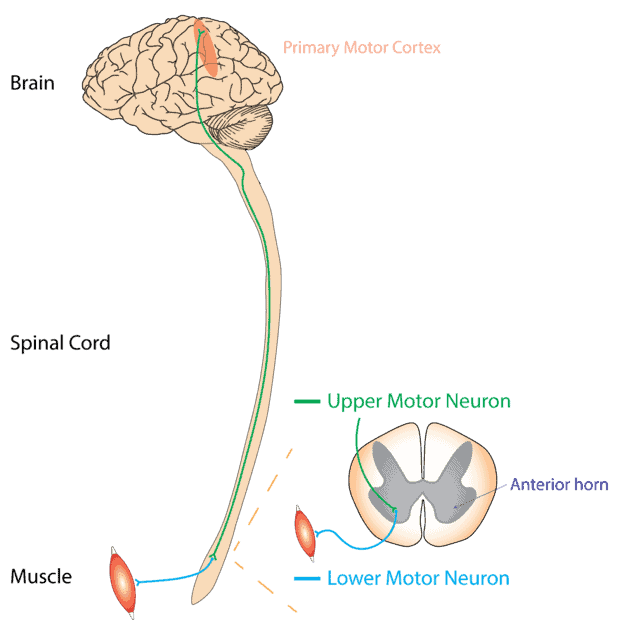
في ALS ، تتأثر كل من الخلايا العصبية الحركية العلوية والسفلية في الدماغ والحبل الشوكي. تشغل الخلايا العصبية الحركية العليا الدماغ بينما توجد الخلايا العصبية الحركية السفلية في النخاع الشوكي. وفقًا لموقع الويب الخاص بـ ALS Pathways ، فإنه ينتشر عادةً من نقطة محورية مما يؤدي إلى تعطيل جميع الخلايا العصبية الحركية في الجسم والتسبب في النهاية في موت الخلايا العصبية الحركية. وهناك عوامل متعددة مسئولة عن هذا النوع من أمراض التنكس العصبي. قد تؤثر الأشكال الأخرى فقط على الخلايا العصبية الحركية العليا (التصلب الجانبي الأولي PLS) أو الخلايا العصبية الحركية السفلية (الضمور العضلي التدريجي ، PMA).
يؤدي تنكس الخلايا العصبية الحركية العليا إلى زيادة توتر العضلات أو الشلل التشنجي. بينما يؤدي تلف العصبون الحركي السفلي إلى زيادة ضعف العضلات. هذا يتعارض مع الأداء السليم للنشاط اليومي.
الأسباب (الجزء 5 من هل ALS وراثي؟)
في التصلب الجانبي الضموري ، يُشتبه في أن الجينات تلعب دورًا في خطر الإصابة بالمرض. تدعم الدراسات بقوة العوامل الوراثية المرتبطة بـ ALS. ومع ذلك ، فإن الدراسات التي تشير إلى دور بعض العوامل البيئية ليست متسقة للغاية. في معظم الحالات ، السبب الدقيق غير معروف. لكن في بقية المجموعة الصغيرة (5-10٪) ، قد تفسر العوامل الوراثية الحالة. قد يكون لعوامل أخرى مثل تاريخ العائلة والجنس والجغرافيا وما إلى ذلك أيضًا ارتباطات بـ ALS.
هل ALS وراثي؟
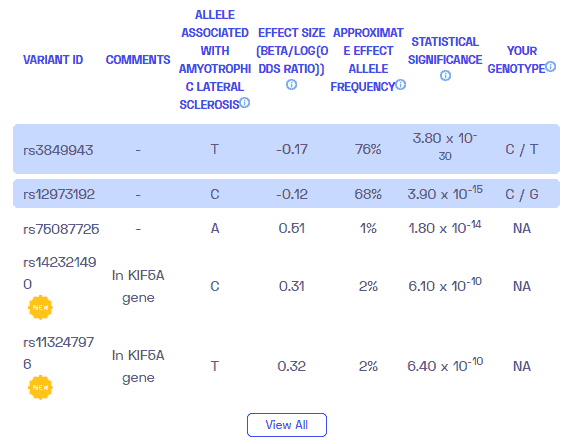
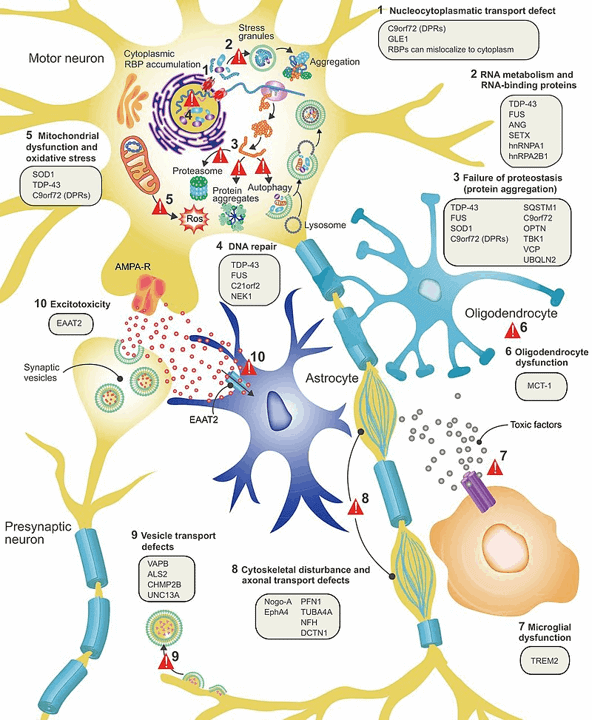
يرتبط عدد من المتغيرات الجينية ارتباطًا وثيقًا بـ ALS. تؤدي الطفرات الجينية المحددة المرتبطة بالمرض إلى التراكم المرضي أو التدهور المبكر للبروتينات الخاطئة التي تؤدي في النهاية إلى التنكس العصبي.
المكونات الجينية الرئيسية في ALS
SOD1: رموز الجين SOD1 لإنزيم يعرف باسم ديسموتاز الفائق. يلعب هذا الإنزيم دورًا مهمًا في آلية مكافحة الدفاع. تؤدي المتغيرات الخاطئة لبروتينات SOD1 إلى التقدم.
TARDBP: يقوم هذا الجين بتشفير TDP-43 ، وهو بروتين ينظم التعبير الجيني. يعتبر TDP-43 أمرًا بالغ الأهمية في مختلف مراحل معالجة الحمض النووي الريبي. تؤدي بعض الطفرات الجينية السائدة في TARDBP إلى خلل في TDP-43 ، مما يتسبب في حدوث تنكس عصبي. وبالتالي ، فإن التغييرات في توزيع ووظائف هذا البروتين لها ارتباط قوي بـ ALS.
FUS: يعبر الجين FUS عن بروتين FUS وهو نوع من بروتين ربط RNA. تشبه بعض وظائفه وظائف بروتين TDP-43. لذلك ، يراقب بروتين FUS عددًا من العمليات في استقلاب الحمض النووي الريبي. في مرض التصلب الجانبي الضموري ، تتسبب المتغيرات المسببة للأمراض لهذا الجين في بعض الأحيان في طي وتوزيع بروتين FUS بشكل غير صحيح ، وبالتالي تتداخل مع فسيولوجيا الخلية الطبيعية.
C9ORF72: على الرغم من أن الدور الدقيق لهذا الجين لم يتضح بعد ، إلا أن القليل من التقارير أشارت إلى تورطه في نقل البروتين خاصة في شكل النشاط الداخلي والالتهام الذاتي. وقد يرتبط انخفاض التعبير عن C9ORF72 بالمرض ، كما لوحظ في بعض الدراسات على الحيوانات. ومع ذلك ، فإن تقليل التنظيم وحده لا يؤدي إلى ALS ، ولكنه في الواقع يعمل في مركب من عدد قليل من البروتينات الأخرى.
المكونات الجينية البسيطة لـ ALS
قليل من المعدلات الجينية الأخرى في ALS هي ATXN1 و ATXN2 و UNC13A. الطفرات في هذه الجينات من المحتمل أن تجعل الناس سريع التأثر للاضطراب. لكنهم لا يرتبطون بقوة بهذا المرض.
المكون غير الجيني لـ ALS (الجزء 7 من هل ALS وراثي؟)
عامل الخطر المهني
عدد من التقارير لديك مقترح أن الرياضيين المحترفين هم الأكثر عرضة للإصابة بمرض التصلب الجانبي الضموري. وقد يكون هذا بسبب إصابات الرأس الشديدة أو الأنشطة البدنية الشديدة.
أمثلة أخرى من التعرض في مكان العمل هي الحالات التي يتعرض فيها الأشخاص لمجالات مغناطيسية أو عمل بدني شاق. ومع ذلك ، فإن هذه الدراسات قائمة على الارتباط ، وغير متسقة ، ومسببات غير معروفة.
الكيماويات السامة
نتائج أ دراسة في جامعة ميشيغان في آن أربور (مايو 2016) أكد الشكوك طويلة الأمد بأن التعرض للسموم البيئية قد يزيد من خطر الإصابة بمرض التصلب الجانبي الضموري. في هذه الدراسة ، لاحظ الباحثون وجود ارتباط كبير بين الاضطراب ووجود الهيدروكربونات المكلورة وثنائي الفينيل متعدد الكلور وثنائي الفينيل متعدد البروم.
بيتا ميثيلامينو ألانين (BMAA)
BMAA هو سم عصبي مرتبط بـ ALS. أفادت التقارير أن السكان الأصليين الذين يعيشون في غوام معرضون بشكل متزايد لخطر الإصابة بالمرض. النظام الغذائي لهذه الفئة من السكان غني بـ BMAA. بشكل عام ، تنتج البكتيريا الزرقاء في مياه جزر المحيط الهادئ BMAA. وبالنظر إلى أن شعب غوام يعتمد على المأكولات البحرية ، فقد يؤدي ذلك إلى ارتفاع عدد السكان مخاطرة .
ميكروبيوم
ميكروبيوم الأمعاء في كثير من الأحيان تأثيرات نتيجة المرض ، كما ورد في الدراسات على الحيوانات. ميكروبيوم الأمعاء دراسات أظهر في الفئران أن هناك صلة مهمة بين بعض السلالات البكتيرية و ALS. علاوة على ذلك ، في هذه الدراسة ، تميل سلالة Akkermansia muciniphila إلى إبطاء تقدم المرض في الفئران. اخر دراسة 2020 في الفئران أن المجتمعات الميكروبية في الأمعاء تؤثر على نتيجة البقاء على قيد الحياة. لوحظ هذا بشكل خاص ، لأن الفئران المعرضة للإصابة بمرض التصلب الجانبي الضموري ، على الرغم من وجود خلفيات جينية متشابهة ، أظهرت اختلافات كبيرة في العمر. كانت أنماط التنوع في المجتمعات الميكروبية مختلفة بشكل كبير – أحد العوامل التي يمكن أن تكون قد ساهمت في الاختلافات في فترة بقاء تلك الفئران.
الأعراض (الجزء 8 من هل ALS وراثي؟)
الأعراض المميزة لمرض التصلب الجانبي الضموري هي ضعف وظيفي في حركة العضلات في الأطراف العلوية والسفلية والعضلات البصلية وعضلات الجذع.
وفقا ل المعهد الوطني للاضطرابات العصبية والسكتة الدماغية تتراكم الأعراض تدريجياً. تتضمن بعض الأعراض المبكرة لـ ALS ما يلي:
- التحزُّم (تشنُّجات العضلات) في الذراع أو الساق أو الكتف أو اللسان
- تشنجات العضلات
- عضلات مشدودة وصلبة (تشنج)
- ضعف العضلات الذي يؤثر على الذراع أو الساق أو الرقبة أو الحجاب الحاجز
- تلعثم في الكلام والأنف
- صعوبة في المضغ أو البلع
اعتمادًا على الأعراض الأولى التي لوحظت ، يمكن تقسيم الحالة إلى فئات فرعية. عندما تبدأ الأعراض لأول مرة في الذراعين أو الساقين ، فإنها تُعرف باسم “بداية الأطراف” ALS. إذا كانت المؤشرات الأولى هي مشاكل في الكلام أو البلع ، فيشار إليها باسم “التصلب الجانبي الضموري”.
يتقدم ALS بشكل مختلف في الأفراد المختلفين. ومع ذلك ، في جميع الحالات ، ينتشر ضعف العضلات وضمورها إلى أجزاء أخرى من الجسم حتى يصبح العمل صعبًا. لن يتمكن الأشخاص الذين يعانون من مراحل متقدمة من المرض في النهاية من الوقوف أو المشي أو استخدام أطرافهم وقد يصبح البلع والتحدث والتنفس صعبًا.
في معظم الحالات ، يحتفظ الأشخاص المصابون بالتصلب الجانبي الضموري بقدرتهم على أداء عمليات عقلية أعلى مثل التفكير والتذكر والفهم وحل المشكلات.
يتراوح متوسط وقت بقاء المريض على قيد الحياة من ثلاث إلى خمس سنوات من بداية المرض ، ومع ذلك ، 10-20 بالمائة يمكن للمرضى البقاء على قيد الحياة لفترة أطول.
التشخيص (الجزء 9 من هل ALS وراثي؟)
في الغالب ، تختلف الأعراض من شخص لآخر. ومن ثم ، سيقوم الطبيب بإجراء فحص شامل باستخدام اختبارات متعددة . حتى الآن ، لا يوجد سريري الاختبارات الجينية لـ ALS.
الفحص البدني: في معظم الحالات ، يؤدي زيادة ضعف العضلات ، أو ضمور العضلات ، أو حتى تشنجات العضلات ، إلى استشارة الطبيب لأول مرة. وتجدر الإشارة إلى أن تشنجات العضلات وحدها تمثل دائمًا تحزمات حميدة. في البداية ، يمكن أن تظهر الأعراض في أي مكان من الجسم. أثناء الفحص ، فإن الظهور المتزامن لعلامات الشلل الرخو والتشنجي يعزز الشك في تشخيص التصلب الجانبي الضموري.
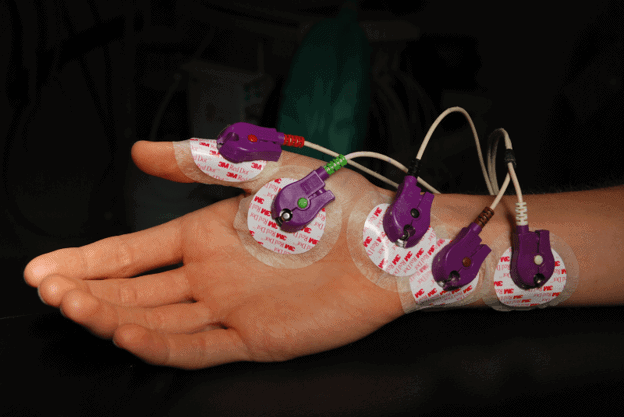
التخطيط الكهربي للعضلات: لا غنى عن الفحص الكهرومغناطيسي والتصوير العصبي الكهربائي لإجراء التشخيص. يقوم مخطط كهربية العضل بتحليل النشاط الكهربائي في العضلات. تم تطوير معايير موحدة دوليًا لإجراء التشخيص (معايير El Escorial). وفقًا لهذه المعايير ، يتطلب التشخيص فحص التنكس في الخلايا العصبية الحركية العلوية والسفلية ، وتطورها ، وكذلك عدم وجود أي مرض تنكسي عصبي آخر.
الصنبور الشوكي: يقوم الطبيب بسحب كمية صغيرة من السائل النخاعي ويبحث عن وجود حالات التهابية أو خلايا غير طبيعية. هذا الاختبار مهم فقط في الحالات ذات الأعراض غير العادية.
خزعة: بشكل عام ، يقوم الجراح بإزالة جزء من العضلة من أعلى الذراع أو أعلى الفخذ. ثم يبحث الجراح عن أي ضرر باستخدام التلوين والفحص المجهري.
العلاج (الجزء 10 من هل ALS وراثي؟)
عادة ، يتكون العلاج من مزيج من العلاج الدوائي والعلاج الموجه للأعراض. يهدف علاج الأعراض إلى المساعدة في تجنب مضاعفات الضعف العضلي وتحسين نوعية حياة المريض. في النماذج الحيوانية والخلايا الجذعية البشرية ، وراثي دراسات حددوا أهدافًا دوائية محتملة ، والتي يمكن أن تكون خطوة إلى الأمام نحو تطوير العلاج الدوائي.
في بعض الأحيان ، قد يرغب الناس في الخضوع لاختبارات جينية خاصة في الحالات التي لها تاريخ عائلي من المرض. بعد ذلك ، في مثل هذه الحالات ، قد يساعد المستشار الجيني في تقييم ليس فقط تاريخ العائلة ، ولكن أيضًا الخلفية الطبية وأي مخاطر محتملة أخرى. بالنسبة لمرض التصلب الجانبي الضموري العائلي ، عادة ما يتم ملاحظة نتيجة اختبار إيجابية في 60-70 في المائة من الحالات.
العلاج الوقائي
ريلوزول هو الدواء الشائع في العلاج الوقائي للأعصاب. يمنع هذا الدواء تدمير الخلايا العصبية الحركية عن طريق منع إطلاق الناقل العصبي الغلوتامات من الخلايا العصبية.
يقال إن إعطاء ريلوزول يطيل البقاء على قيد الحياة بحوالي ثلاثة أشهر ويطيل المراحل المبكرة من ALS. ومع ذلك ، تجدر الإشارة إلى أن تطور المرض لا يمكن إيقافه بالكامل بواسطة ريلوزول.
اعتبارًا من عام 2017 ، منحت إدارة الغذاء والدواء الأمريكية الموافقة على عقار آخر Edaravone. يشير إلى إبطاء تطور ALS.
علاج الأعراض
غالبًا ما يتم علاج الأعراض التالية بالعلاجات المناسبة:
- تشنجات العضلات
- عسر البلع
- سيلان اللعاب
- اضطراب الكلام والتواصل
- الضحك والبكاء المرضي
- اضطرابات في الجهاز التنفسي
- الاكتئاب واضطراب النوم والقلق
آخر الأخبار (2020)
بدأ الباحثون في كلية ترينيتي في دبلن برنامج المرحلة الأولى من التجارب السريرية للعلاج الجيني في مرفق الأبحاث السريرية ، مستشفى سانت جيمس بدبلن (اعتبارًا من 1 سبتمبر 2020). يستهدف هذا العلاج الجيني الجين C9ORF72. قامت شركة الأدوية الأمريكية Biogen برعاية هذه التجربة السريرية.
هل أعجبك هذا المقال؟ تأكد من إطلاعك على المنشورات الأخرى في مكتبة أبحاث السديم !